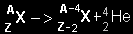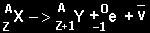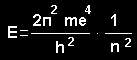|
|
|
|
![]()
(c
 |
|
|
)
|
Atomo sandara |
||
|
čia
Z -
protonų skaičius,
N -
neutronų skaičius. Elemento
X
žymėjimas:
Masės defektas
čia
Z · m(p) + N · m(n) ―
protonų
ir neutronų, sudarančių branduolį, masė,
m (branduolio) -
branduolio masė.
Branduolio ryšio
energija
Radioaktyvusis α skilimas
- branduolys
išspinduliuoja
α
daleles ( Radioaktyvusis β skilimas - branduolys išspinduliuoja elektronus:
Radioaktyviojo skilimo lygtis
čia
m (t) -
branduolio masė
laiko momentu
t,
m0
-
pradinė branduolio
masė, k
-
radioaktyviojo skilimo konstanta,
T1/2 =
ln 2/k -
pusėjimo trukmė.
De Broilio (De Broglie)
lygtis
čia
λ -
elektrono bangos
ilgis, h -
Planko
konstanta, lygi 6,62
· 10-34
J · s,
m -
elektrono masė,
v -
elektrono
judėjimo greitis.
Geizenbergo (Geisenberg)
neapibrėžties lygtis
Boro (Bohr) postulatai čia m, v - elektrono masė ir greitis, r - jo orbitos spindulys, n - pagrindinis kvantinis skaičius, h - Planko konstanta. 2. En ― Em = hv čia En, Em - elektronų, pereinančių iš n-tosios į m-tąją orbitalę, išspinduliuota energija, v - šviesos dažnis, kurį atomai išspinduliuoja arba sugeria pereinant elektronams. Vandenilio atomo elektrono n-tojoje orbitalėje energija
čia e = 1,6 · 10-19 C - elektrono krūvio absoliutus dydis. Atomo elektrono kvantiniai skaičiai
1. Pagrindinės kvantinis skaičius
2. Optinis (šalutinis)
kvantinis skaičius Duotajam kvantiniam skaičiui n galimos orbitinio kvantinio skaičiaus l skirtingos n reikšmės.
3. Magnetinis kvantinis
skaičius
4.
Sukinio kvantinis skaičius
Atominių
orbitalių užpildymo elektronais taisyklės Jonizacijos potencialas (energija) I - energija, kurios reikia iš atomo atimti silpniausiai surištą elektroną: X + I ―> X+ + e- Elektroninis giminingumas E - energija, kuri išsiskiria atomui prisijungus elektroną:
X + e
―> X-
+ E |
|

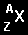 (pavyzdžiui
(pavyzdžiui 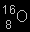 )
)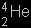 ):
):