|
Mendelejevo-Klapeirono lygtis
Boilio (Boyle)-Marioto (Mariotte) dėsnis
Gei-Liusako (Gay-Lussac) dėsnis
Bendrasis dujų
dėsnis
Avogadro
dėsnis
Molinis dujų tūris
Dujų tankis
Santykinis dujų B tankis dujų A atžvilgiu
Dujų A
tūrio dalis mišinyje
Mišinio, susidedančio iš n dujų,
vidutinė molekulinė masė
Mendelejevo-Klapeirono
lygtis idealiosioms
dujoms:
PV =
nRT,
arba
PV =
(m/M) ·
RT,
čia
P -
slėgis,
V -
tūris,
n -
dujinės medžiagos kiekis (mol),
R -
universalioji
molinė dujų konstanta, lygi 8,314 J/(mol·K)
= 0,082 l
· atm/(mol·K),
T -
absoliučioji (termodinaminė)
temperatūra,
m
- dujų masė,
M -
dujų molinė masė.
Boilio (Boyle)-Marioto
(Mariotte) dėsnis :
PV = const,
arba
P1V1 = P2V2,
galioja,
jei T
=
const.
Gei-Liusako (Gay-Lussac)
dėsnis
V/T
=
const,
arba
V1/T1
=
V2/T2,
galioja, jei
P
=
const.
Bendrasis dujų dėsnis
PV/T
=
const,
arba
P1V1/T1
= P2V2/T2,
galioja,
jei P
=
const
ir
T
=
const.
Avogadro dėsnis
V1/V2
= n1
/
n2
galioja, jei
P
=
const
ir
T
=
const.
Molinis dujų tūris
VM
=
V/n = RT/P
normaliomis sąlygomis (P
= 101,3 kPa, T = 273 K)
VM
= 22,4 l/mol
Dujų tankis
ρ = m / V =
(P / RT)
· M
= M / Vm,
čia
M -
molinė masė,
Vm -
molinis tūris.
Santykinis dujų B tankis dujų A
atžvilgiu
DA(B) =
ρ(B)
/ρ(A)
= M(B)
/M(A),
čia
M -
dujų molinė masė
Dujų A
tūrio dalis mišinyje
φ(A)
= V(A)
/V(A)
+ V(B)
+ ...);
φ(A)
= ν(A)
/ν(A)
+ ν(B)
+ ...),
čia
V -
dujų tūris,
ν -
dujinės medžiagos
kiekis.
Mišinio, susidedančio iš n dujų, vidutinė
molekulinė masė
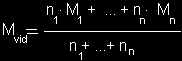
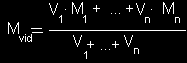
Mvid =
φ1
· M1 + ... + φn
· Mn
čia
M -
dujų molinė masė,
n -
dujinės medžiagos kiekis,
V -
dujų tūris,
φ-
dujų tūrinė dalis.
|

![]()

