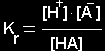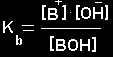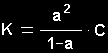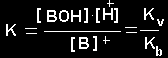|
|
|
|
![]()
(c
 |
|
|
)
|
Tirpalai Elektrolitinė disociacija |
||
|
Tirpinio masės dalis
Tirpumas
s
- medžiagos masė, kuri gali ištirpti 100 g tirpiklio. tirpumas
su masės dalimi susietas taip:
Molinė tirpinio
dalis
(bedimensis
dydis)
čia
ni -
tirpinio kiekis,
Σni -
visų
medžiagų, sudarančių tirpalą, kiekis.
Molinė tirpinio koncentracija
(mol/l)
čia ρ - tirpalo tankis (g/ml), M(medžiagos) - medžiagos molinė masė (g/mol).
Disociacijos laipsnis
čia
n/ -
molekulių, disocijavusių į jonus, skaičius,
n -
bendras ištirpusių
molekulių skaičius.
α
dydžio skaitinė vertė gali kisti nuo 0 (medžiagos nedisocijuoja)
iki 1 (visiškai disocijuoja).
Disociacijos konstanta K
- pusiausvyros
konstanta, apibūdinanti elektrolito elektrolitinę disociacija.
Rūgštys,
kurių disociacijos lygtis yra čia A- - rūgšties liekana, disociacijos konstanta
Tarp skliaustų rašomos jonų ir molekulių pusiausvirosios molinės koncentracijos tirpale.
Bazių,
kurių disociacijos lygtis yra čia B+ - bazės liekana,
disociacijos
konstanta
Ostvaldo (Ostwald) praskiedimo
dėsnis
čia
C - AB
tipo
elektrolito molinė koncentracija.
Vandens joninė sandauga KV
-
vandens disociacijos konstanta
25 °C
temperatūroje
KV
= 1
·
10-14
Hidrolizės konstanta
-
pusiausvyros konstanta, apibūdinanti jonų sąveika su vandeniu.
hidrolizės konstanta
Vandenilio jonų rodiklis Gryno vandens ir neutralių tirpalų pH = 7, rūgščių tirpalų pH < 7, šarminių tirpalų pH > 7. Tirpumo
sandauga TS
- tai pusiausvyros konstanta, apibūdinanti blogai tirpstančių
medžiagų disociaciją.
AmBn
<―> mAn+ + nBm- |
|