|
(c
)
|
| |
| |
Pagrindiniai cheminės
kinetikos dėsningumai |
|
| |
|
Dėsningumas |
Formuluotė |
Matematinė išraiška |
Veikiančiųjų masių dėsnis
(pagrindinis cheminės
kinetikos dėsnis) |
Cheminės reakcijos greitis proporcingas reaguojančių
medžiagų koncentracijų sandaugai
|
Reakcijos
A + B → C
+ D
greitis
v
= k
· CA
· CB,
čia,
k
- reakcijos greičio konstanta,
CA
, CB
-
A
ir
B
medžiagų
koncentracijos
|
|
Arenijaus lygtis |
Cheminės reakcijos greitį ir temperatūrą sieja
eksponentinė priklausomybė |
k
= A · e - Ea/
RT
arba
lg k =
lgA – Ea/2,303 RT,
čia,
k
- reakcijos greičio konstanta,
A
- Arenijaus
konstanta (apibūdinanti kiekvieną konkrečią reakciją),
Ea
-
aktyvacijos energija,
R
-
universalioji (molinė) dujų konstanta,
T
-
temperatūra |
Van,t Hofo
(van,t
Holf)
taisyklė |
Pakėlus temperatūrą 10°C,
daugelio reakcijų greitis padidėja 2-4 kartus |
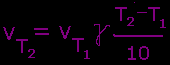
čia
V2
,
V1
- reakcijų
greičiai
T1
ir
T2
temperatūroje, 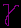 -
eakcijos greičio temperatūros koeficientas, rodantis,
kiek kartų padidės reakcijos greitis, pakėlus
temperatūrą 10°C -
eakcijos greičio temperatūros koeficientas, rodantis,
kiek kartų padidės reakcijos greitis, pakėlus
temperatūrą 10°C
|
Le Šateljė
(Le Chatelier)
principas
(atoveiksmio
principas |
Jei pusiausvirąją sistemą
veikia išorinis veiksnys, tai nuo jo priklauso tik ta iš
dviejų priešingų reakcijų, kuri susilpnina (sumažina) šį
poveikį.
Katalizatoriai vienodai greitina ir tiesioginę, ir
atvirkštinę reakciją; nuo jų pusiausvyra nepriklauso |
|
Pavyzdžiai:
1)
pakėlus
temperatūrą, pusiausvyra pasistūmėja taip, kad vyktų
endoterminė reakcija, temperatūrai sumažėjus- kad vyktų
egzoterminė reakcija;
2) padidėjus slėgiui, pusiausvyra pasislenka taip, kad
tūris sumažėtų, o sumažėjus slėgiui - kad tūris
padidėtų;
3) produktų pašalinimas iš reakcijos terpės pastumia
pusiausvyrą taip, kad vyktų tiesioginė reakcija
|
|
|
|
|
|

![]()
