
![]()
(c
 |
)
|
Chloras |
||||
|
|
||||
 |
||||
| Naudojimas: valgomoji druska (NaCl) chlorkalkės (NaOCl), druskos rūgštis (HCl), PVC – plastikinės medžiagos. | ||||
 |
||||
| Sąveika su vandeniu | ||||
|
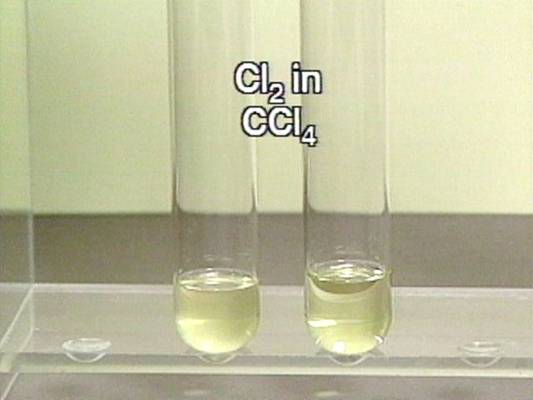
Chloras reaguoja
su vandeniu: Cl2 (d) + H2O (s) → HCl (aq) + HClO (aq) |
||||
 |
 |
|||
| Sąveika su rūgštimis | ||||
|
Chloras reaguoja su koncentruota
azoto rūgštimi:
3Cl2 (d) + 10HNO3 (konc.) → 6HClO3 (aq) + 10NO (d) + 2H2O (s) |
||||
 |
 |
 |
||
| Sąveika su šarmais | ||||
|
Tirpdamas šarmuose
chloras disproporcionuoja: Cl2 (d) + 2NaOH (aq) → NaCl (aq) + H2O (s) + NaOCl (aq) (Žavelio vanduo) |
||||
 |
 |
 |
||
 |
||||
|
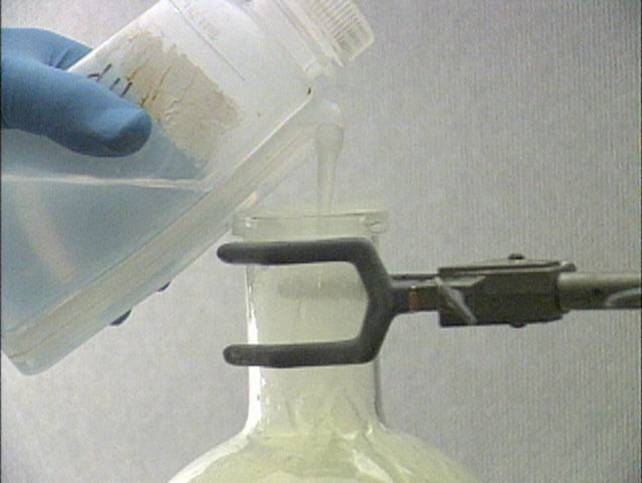
Chloro sąveika su metalais
su geležimi Geležis ir chloras kambario temperatūroje ne iškart sureaguoja, bet įkaitinus geležį reakcija vyksta intensyviai. Reakcijos metu gali susidaryti geležies (II) ir geležies (III) chloridai. Bet geležis visiškai oksiduojasi iki FeCl3, todėl reakcijos produktas yra rudos spalvos. Kolba perplaunama vandeniu. Geležies (III) chloridas tirpsta vandenyje – susidaro oranžinės spalvos tirpalas. |
||||
 |
 |
 |
||
 |
 |
 |
||
|
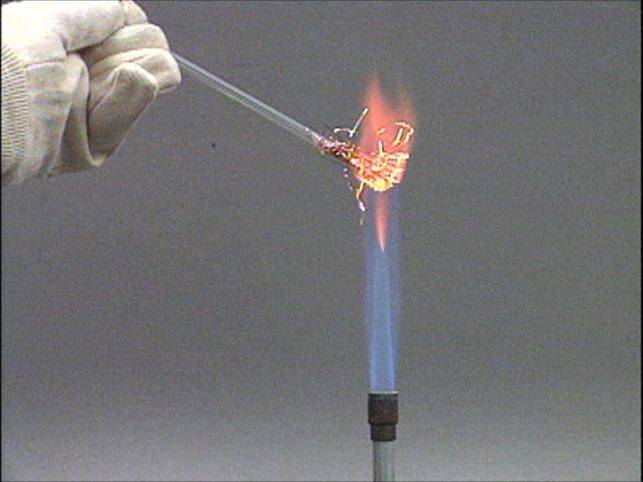
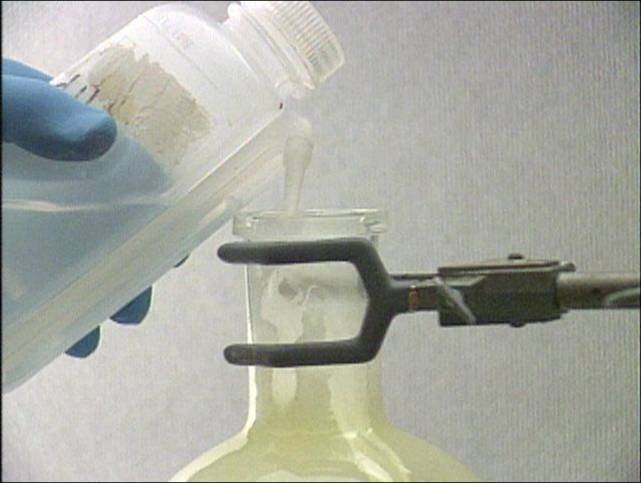
su variu
Varis ir chloras kambario temperatūroje ne iškart sureaguoja, bet
įkaitinus varį reakcija vyksta energingai. Reakcijos metu gali susidaryti
vario (I) ir vario (II) chloridai. Bet varis visiškai oksiduojasi iki CuCl2.
Reakcijos produktą ištirpinus vandenyje susidaro mėlynai žalios spalvos
vario (II) chlorido tirpalas. Vario (I) chloridas yra bespalvis. |
||||
 |
 |
 |
||
 |
 |
|||
|
su aliuminiu
Aliuminis ir chloras kambario temperatūroje ne iškart su-reaguoja, bet
įkaitinus aliuminį reakcija vyksta intensyviai. Reakcijos metu susidaro
baltos spalvos aliuminio chlorido milteliai, kurie reaguodami su vandeniu
‘’verda’’ ore ir susidaro HCl dujos ir aliuminio oksidas. |
||||
 |
 |
 |
||
 |
||||
|
Chloro sąveika su nemetalais su vandeniliu Vandenilis ir
chloras kambario temperatūroje nereaguoja. Kad reakcija įvyktų,
reikia vandenilį padegti. Liepsnojanti vandenilį įleidžiame į
cilindrą, pripildytą chloro. Vyksta reakcija tarp vandenilio ir
chloro. Jos metu susidaro vandenilio chloridas. Kamštį nuo
butelio, pripildyto amonio hidroksidu tirpalo, priartinus prie
liepsnos, pasirodo balti amonio chlorido dūmai, kurie įrodo, kad
susidaro vandenilio chloridas. |
||||
 |
 |
 |
||
 |
||||
|
su acetilenu
Acetilenas
gaminamas kalcio karbidui reaguojant su vandeniu, reakcija
vyksta cilindre, pripildytam chloro dujų: |
||||
 |
|
 |
||
 |
||||
|
su jodu
Chloro dujos
praleidžiamos pro jodo kristalus, kurie yra kapiliariniame
vamzdelyje. Susidaro rudos spalvos dūmai – jodo monochloridas: |
||||
 |
 |
 |
||
 |
||||
Vienintelis visų teisių savininkas (įskaitant visas su juo
susijusias autorines teises) į
Chemistry Comes Alive!
vaizdinę – foto medžiagą yra
Journal of Chemical Education.
Visos teisės saugomos. Naudojama turint leidimą.



