|
(c
)
|
| |
|
Pagrindinės elektrochemijos sąvokos ir dėsniai |
|
|
|
Teorijos teiginiai |
Pavyzdys |
Galvaninis elementas
(cheminis elektros srovės
šaltinis)
|
Įrenginys,
kuriame oksidacijos -redukcijos reakcijų cheminė
energija virsta elektros energija. Susideda iš dviejų
skirtingų metalų, tarp kurių yra elektrolitas |
Standartinis elektrodo
potencialas |
Dydis, rodantis gebėjimą redukuotis:
Xn++
ne- ―> X0.
Dalinės
reakcijos 2H+
+ 2e-
―> H20
standartinis elektrodo potencialas laikomas lygus
0
- |
|
Metalų elektrocheminė
įtampų eilė
(metalų aktyvumo eilė) |
Metalų eilė, kurioje jie išdėstyti standartinio
elektrodo potencialo algebrinių verčių didėjimo seka:
Li, K, Ba, Sr, Ca, Na,
Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Hg,
Ag, Pd, Pt, Au
|
Elektrolizė
|
Oksidacijos -redukcijos
reakcijų, kuriose vyksta ant elektrodų elektrolitų
tirpaluose ar lydaluose leidžiant per juos elektros
srovę visuma |
Faradėjaus (Faraday)
konstanta
|
Vieno molio elektronų
krūvis |
Pirmasis Faradėjaus
dėsnis
|
Junginio, susidariusio
ant elektrodų, masė tiesiog proporcinga pro tirpalą
pratekėjusios srovės kiekiui |
|
Antrasis Faradėjaus
dėsnis |
Elektros krūvis,
pratekėjęs pro elektrolitą, išskiria medžiagos kiekį,
proporcingą jos cheminiam ekvivalentui
|
Pirmojo ir antrojo
Faradėjaus dėsnių suminė formulė
|
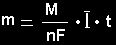
čia
m -
junginio, išsiskyrusio
ant elektrodo. masė,
M -
medžiagos molinė masė,
n -
elektronų, dalyvaujančių
elektrodiniame procese, skaičius,
F -
Faradėjaus konstanta,
I
- srovės stipris,
t -
elektrolizės laikas
|
|
|
|

![]()
