
![]()
(c
 |
)
|
Jodas |
||||
|
|
||||
 |
||||
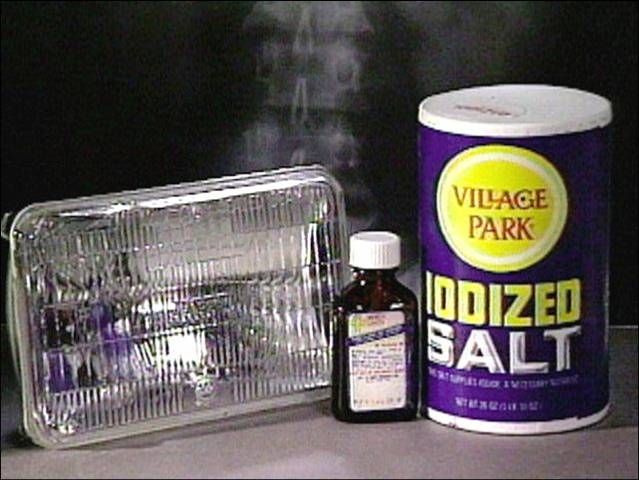
| Naudojimas: automobilio žibintai (CH3I), jodo tinktūra, druska su jodu (KI+Ca(IO3)2), vaistai. | ||||
 |
||||
| Sąveika su baze | ||||
|
Jodas tik nežymiai
tirpsta vandenyje, tačiau gerai tirpsta organiniuose
tirpikliuose, pvz., CCl4. Jodas - chemiškai aktyvi
medžiaga – reaguoja su NaOH: 3I2 (k)+ 6NaOH (aq) → 5 NaI (aq)+ NaIO3 (aq) +3H2O (s) |
||||
 |
 |
 |
||
 |
 |
|||
| Jodo laikrodžio reakcija | ||||
|
Reagentai:
Vandenilio peroksido ir sieros rūgšties mišinys supilamas į
buteliuką, pripildytą jodido, tiosulfato jonų ir krakmolo
tirpalų. Reakcija vyksta labai lėtai. Reakcijos metu
susiformuoja trijodidas, kuris greitai rea-guoja su tiosulfatu -
tol, kol pastarasis visiškai sunaudojamas: H2O2 + 3 I- + 2 H+ → I3- + 2 H2O I3- + 2 S2O32- → 3 I- + S4O62- Trijodido perteklius reaguoja su krakmolu ir susidaro kompleksinis mėlynos spalvos jonas I3- + krakmolas → mėlynas krakmolo-I3- kompleksas |
||||
 |
 |
 |
||
 |
||||
|
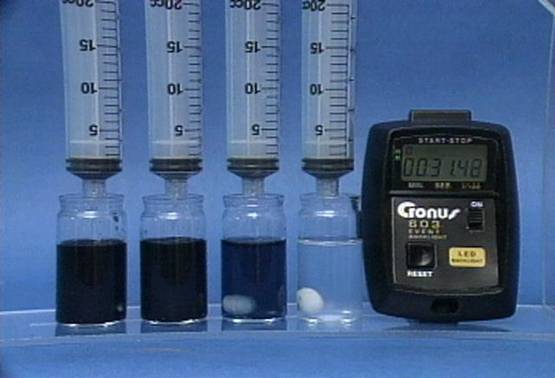
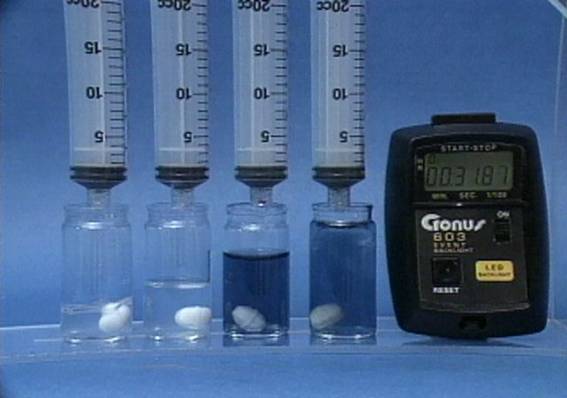
Rūgštingumo poveikis jodo laikrodžio reakcijai Į 4 buteliukus įpilama skirtingos koncentracijos sieros rūgšties tirpalų. Visuose buteliukuose kitų reagentų koncentracijos vienodos. Kuo didesnis tirpalo rūgštingumas, tuo greičiau vyksta reakcija. |
||||
|
|
 |
 |
||
 |
 |
|||
|
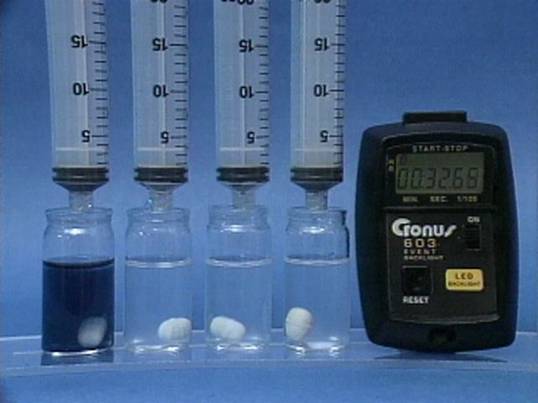
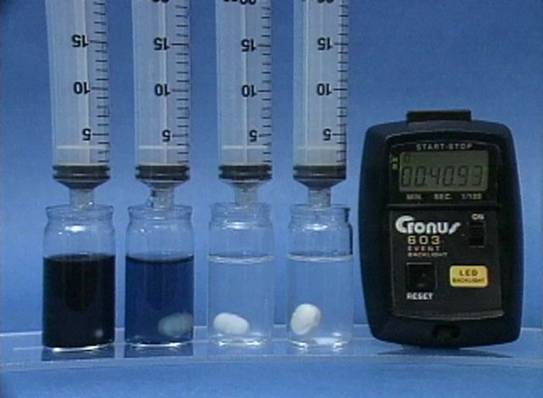
Jodido jonų
poveikis jodo laikrodžio reakcijai Į 4 buteliukus įpilama skirtingos koncentracijos jodido jonų tirpalų. Visuose buteliukuose kitų reagentų koncentracijos vienodos. Kuo didesnė jodido jonų koncentracija, tuo greičiau vyksta reakcija. |
||||
 |
 |
 |
||
 |
 |
|||
|
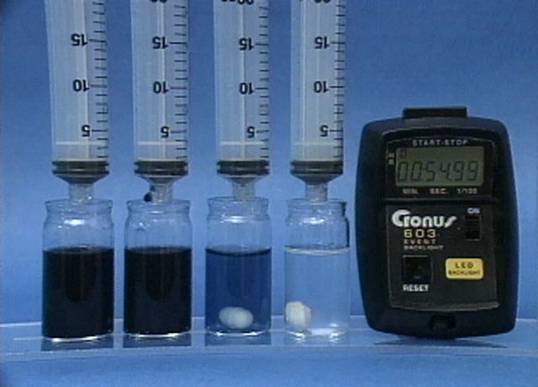
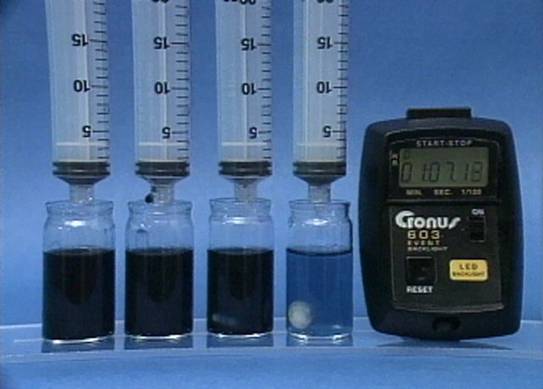
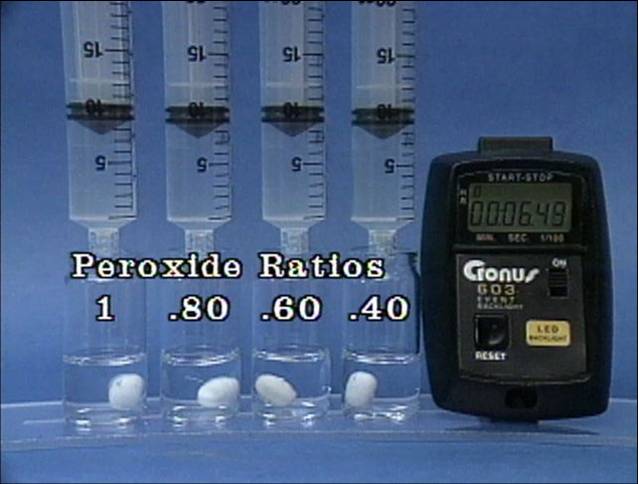
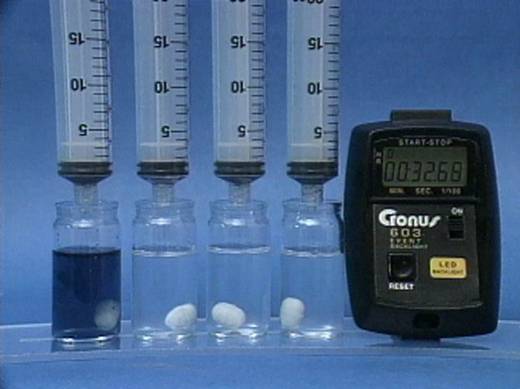
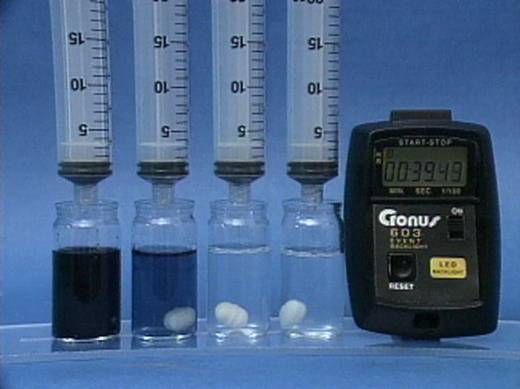
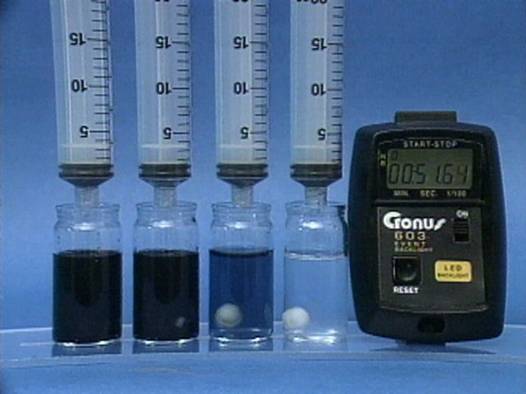
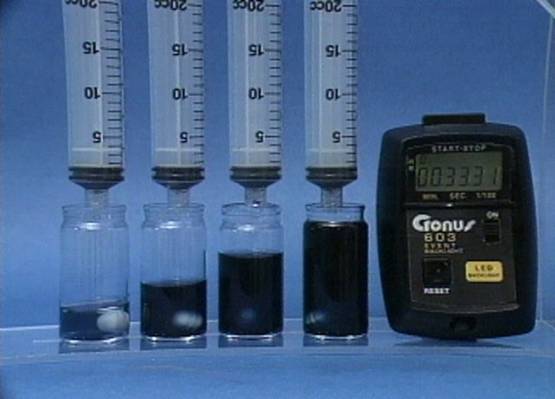
Vandenilio peroksido jonu poveikis jodo laikrodžio reakcijai
Į 4
buteliukus įpilama skirtingos koncentracijos vandenilio peroksido tirpalų.
Visuose buteliukuose kitų reagentų koncentracijos vienodos. |
||||
 |
 |
 |
||
 |
 |
|||
|
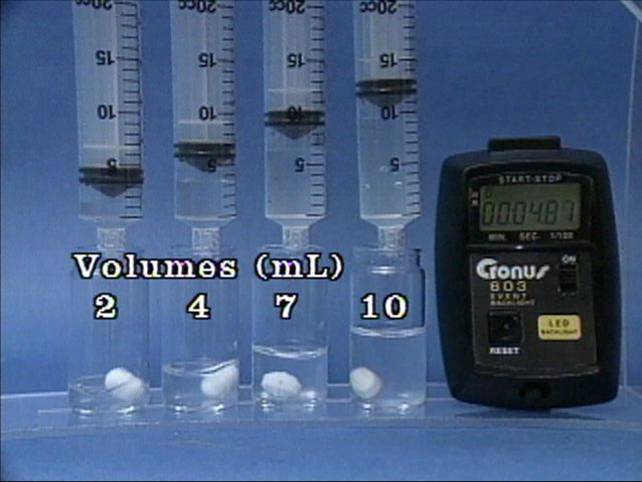
Tirpalų tūrių poveikis jodo laikrodžio reakcijai Į 4 buteliukus įpilama skirtingų tūrių tirpalų. Visuose buteliukuose kitų reagentų tūriai taip pat skirtingi, koncentracija visų tirpalų vienoda. Tirpalų tūriai neturi jokio poveikio reakcijos greičiui. |
||||
 |
 |
 |
||
 |
 |
|||
|
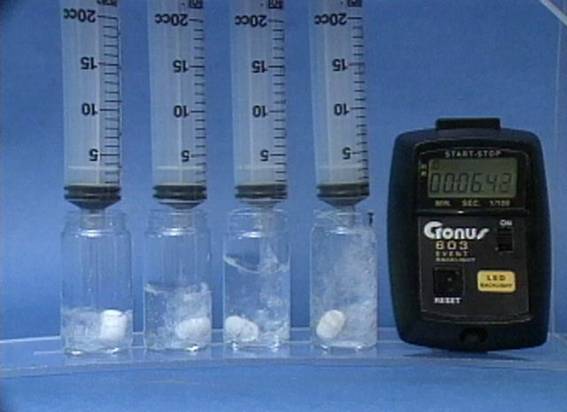
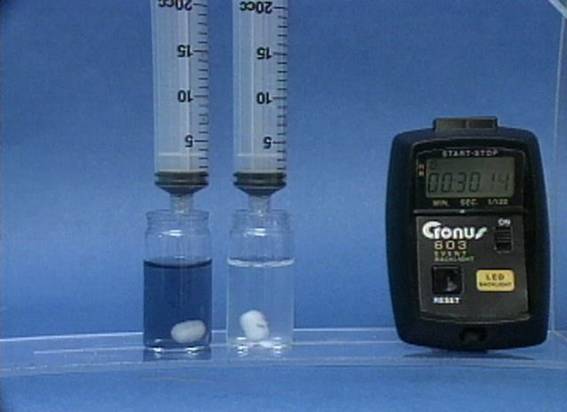
Temperatūros
poveikis jodo laikrodžio reakcijai Į 2 buteliukus, pripildytus vienodų jodidų, tiosulfato jonų ir krakmolo tirpalų, supilamas tas pats vandenilio peroksido ir sieros rūgšties mišinys. Skiriasi tik tirpalų temperatūra. Kuo didesne temperatūra, tuo greičiau vyksta reakcija. |
||||
 |
|
 |
||
 |
|
|||
| Sąveika su metalų | ||||
|
su aliuminiu
Reagentai: jodo ir aliuminio milteliai, vanduo. Aliuminio ir jodo milteliai sumaišomi. Vienas arba du vandens lašeliai įlašinami į pagamintą mišinį. Netrukus įvyksta galinga egzoterminė reakcija. Aliuminis – stiprus reduktorius, jodas – stiprus oksidatorius, aliuminio jodidas – reakcijos produktas: 2Al (k) + 3I2 (k) → 2AlI3 (k) |
||||
 |
|
 |
||
 |
||||
|
su manganu Reagentai: jodo ir magnio milteliai, vanduo. Sumaišius mangano ir jodo miltelius, reakcija nevyksta, bet, įlašinus keletą vandens lašų, reakcija įvyksta. Ši reakcija vyksta intensyviai, bet jos metu liepsna nepasirodo. Mangano reakcija su jodu yra mažiau intensyvi: Mn (k) + I2 (k) ―> MnI2(k) Tirpalų tūriai neturi jokio poveikio reakcijos greičiui. |
||||
 |
|
 |
||
 |
||||
|
su geležimi Reagentai: jodo ir geležies milteliai, vanduo. Sumaišius geležies ir jodo miltelius, reakcija nevyksta, bet, įlašinus keletą vandens lašų, reakcija įvyksta. Ši reakcija vyksta smarkiai, bet ne taip smarkiai kaip su aliuminiu ir manganu. Geležis - ne toks stiprus oksidatorius, palyginus su aliuminiu ir manganu: Fe (k) + I2 (k) ―> FeI2 (k) |
||||
 |
|
 |
||
 |
||||
|
su nikeliu Reagentai: nikelio ir jodo milteliai, vanduo. Sumaišius nikelio ir jodo miltelius, reakcija nevyksta, įlašinus keletą vandens lašų, reakcija taip pat nevyksta. Palyginus su kitais metalais, nikelis nėra stiprus reduktorius. |
||||
 |
|
 |
||
 |
||||
|
su cinku Reagentai: cinko ir jodo milteliai, vanduo. Sumaišius cinko ir jodo miltelius, reakcija nevyksta, bet, įlašinus keletą vandens lašų, reakcija įvyksta. Ši reakcija egzoterminė, jos energijos užtenka jodui išgarinti. |
||||
 |
|
 |
||
 |
|
 |
||
|
Kuo didesnis standartinis potencialas, tuo metalas yra stipresnis reduktorius. |
||||
Vienintelis visų teisių savininkas (įskaitant visas su juo
susijusias autorines teises) į
Chemistry Comes Alive!
vaizdinę – foto medžiagą yra
Journal of Chemical Education.
Visos teisės saugomos. Naudojama turint leidimą.











