|
Elektrolitinės
disociacijos kiekybinės charakteristikos |
|
|
|
Sąvoka |
Sąvokos apibrėžimas |
Matematinė išraiška |
Disociacijos laipsnis (α)
|
Suskilusių į jonus (n') ir visų
ištirpusių molekulių (n) skaičiaus santykis
|
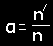
0 ≤ α≤ 1
|
|
Stiprusis elektrolitas |
Elektrolitas, kuris
praktiškai visiškai disocijavęs į jonus:
1) beveik visos druskos;
2) šarmai;
3) stipriosios neorganinės rūgštys
|
α > 0,3
|
Silpnasis elektrolitas
|
Elektrolitas, tik iš dalies disocijuojantis į jonus:
1) beveik visos organinės rūgštys;
2) kai kurios neorganinės rūgštys;
3) dauguma metalų bazių (išskyrus šarminių ir šarminių
žemių metalų), NH4OH;
4) vanduo
|
α < 0,3 |
Disociacijos konstanta |
Pusiausvyros konstantą,
apibūdinanti elektrolitinę disociaciją |
Rūgštims
HA
‹---› H+ + A-
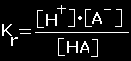
Bazėms
BOH
‹---› B+ + OH-
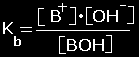
indeksas r
arba
b
rodo, kokia disociacija -
rūgštinė ar bazinė
|
Ostvaldo (Ostwald)
praskiedimo dėsnis
|
Rodo ryšį tarp
disociacijos konstantos ir disociacijos laipsnio |
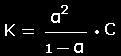
čia
C
- molinė koncentracija
|
Joninė vandens
sandauga (Kw) |
Vandens disociacijos
konstanta |
H2O
‹---› H+ + OH-
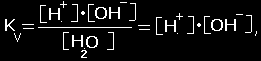
kadangi
[H2O]
>> [H+], [OH-] |
Vandenilio jonų
rodiklis (pH)
|
Dydis, nusakantis
vandenilio jonų koncentraciją ir terpės rūgštingumą |
pH = - lg [H+] |

![]()
