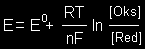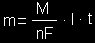|
|
|
|
![]()
(c
 |
|
|
)
|
Oksidacijos-redukcijos reakcijos |
||
|
Oksidacijos-redukcijos reakcijos (bendra schema): Oksidatorius + Reduktorius ―> Reakcijos produktas
Oksidacijos-redukcijos
reakcija susideda iš dviejų dalinių reakcijų: Reduktorius ― ne- ―> Reakcijos produktas ― oksidacijos reakcija Svarbiausios redukcijos dalinės reakcijos: MnO4- + 8H+ + 5e- ―> Mn2+ + 4H2O MnO4- + 2H2O + 3e- ―> MnO2 + 4HO- MnO4- + 2H2O + 3e- ―> MnO42- NO3- + 2H+ + e- ―> NO2 + H2O NO3- + 4H+ + 3e- ―> NO + 2H2O SO42- + 4H+ + 2e- ―> SO2 + 2H2O Cr2O32- + 14H+ + 6e- ―> 2Cr3+ + 7H2O H2O2 + 2H+ + 2e- ―> 2H2O H2O2 + 2e- ―> 2HO- Cl2 + 2e- ―> 2Cl- O2 + 4H+ + 4e- ―> 2H2O Svarbiausios oksidacijos dalinės reakcijos: H2S - 2e- ―> S + 2H+ H2S + 4H2O - 8e- ―> SO42- + 10H+ 2I- - 2e- ―> I2 Fe2+ - e- ―> Fe3+ Me - ne- ―> Men+ Standartinis vandenilio elektrodas - tai oksidacijos-redukcijos elektrodas, antnkurio vyksta dalinė reakcija 2H+ + 2e- <―> H2
kai vandenilio slėgis 1,01
· 105 Pa (1 atm), vandenilio
jonų H+ koncentracija 1mol/l ir temperatūra 25°C Oksidacijos-redukcijos potencialas E Oksidatorius + ne- ―> Reakcijos produktas oksidacijos gebos kiekybinė charakteristika lyginant su standartiniu vandenilio elektrodu:
čia E0
-
standartinis oksidacijos-redukcijos
potencialas (jei [Oks.] = [Red.] = 1 mol/l),
R - universalioji dujų konstanta, Metalo standartinis elektrodo potencialas E0 - standartinis dalinės reakcijos Men+ + ne- ―> Me potencialas. Metalų elektrocheminė įtampų eilė - metalų eilė, sudaryta pagal standartinio elektrocheminio potencialo vertes (didėjimo kryptimi):
Li K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H
Bi Cu Hg Ag Pt Au
Faradėjaus elektrolizės dėsnis
|
|