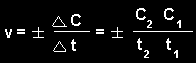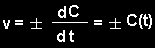|
|
|
|
![]()
(c
 |
|
|
)
|
Cheminių reakcijų greitis |
||
|
Cheminės reakcijos vidutinis greitis per laiką Δt:
čia
C2
ir
C1
-
medžiagos molinės koncentracijos laipsnio momentas
t1, t2.
Ženklas "+" rašomas,
jei greitis nustatomas pagal reakcijos produktą, "-" - jei pagal
pradinės medžiagas. Momentinis greitis nustatomas iš koncentracijos išvestinės pagal laiką:
reakcijai A
―> B + ... v = k
· CA
Vant Hofo (vant Hoff) taisyklė pakėlus temperatūrą dešimčia laipsnių, daugumos reakcijų greitis padidėja 2-4 kartus: vT2 = vT1 · γ(T2 - T1) / 10 čia γ = 2 - 4 - reakcijos greičio temperatūrinis koeficientas. Arenijaus lygtis greičių konstantai: k(T) = A · e-EA / (RT)
čia
A -
konstanta,
priklausanti nuo reaguojančių medžiagų prigimties,
EA -
reakcijos aktyvacijos energija,
R -
universalioji (molinė) dujų
konstanta. |
|