|
Teorija |
Teorijos esmė |
Pavyzdžiai |
|
Arenijaus
(Arrhenius) elektrolitinės disociacijos teorija |
Rūgštys -
tai junginiai, kurie
disocijuodami vandenyje sudaro tik H+
katijonus.
Bazės -
tai junginiai,
kuriems disocijuojant vandenyje susidaro tik OH-
jonai. |
Rūgštis:
HCl (aq) ‹--› H+ (aq) +
Cl- (aq)
Bazė: NaOH (aq)
‹--› Na+ (aq) + OH-
(aq)
|
|
Protolitinė
Brionstedo
(Brönsted)
ir
Lorio
(Laury) teorija |
Rūgštys - tai
junginiai, kurie vykstant reakcijai atiduoda protonus (protonų
donorai)
Bazės -
tai junginiai,
kurie šioje reakcijoje prisijungia protonus (protonų
akceptoriai) |
HCl
(aq) + NH3
(aq)
‹--› NH4
+ (aq) + Cl- (aq)
rūgštis
bazė
rūgštis
bazė
|
|
Solvolizės
teorija |
Rūgštys - tai
junginiai, kurie disocijuodami sudaro tokius pačius
katijonus kaip ir disocijuojant tirpikliui
Bazės -
tai medžiagos,
kurioms disocijuojant, susidaro tokie pat anijonai kaip
ir disocijuojant tirpikliui |
Tirpiklio disociacija
2NH3
(aq)
‹--› NH4
+ (aq) + NH2- (aq)
Neutralizacijos reakcija
NH4Cl
(aq) + NaNH2 (aq)
→
2NH3
(aq) + NaCl(aq) |
Luiso
(Lewis)
teorija |
Rūgštys - tai
jonai ar neutralios molekulės, kurie gali prisijungti
vieną ar keletą elektronų porų
Bazės -
tai jonai ar
neutralios molekulės, kurie gali atiduoti elektronų
poras |
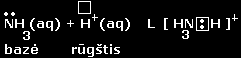 |

![]()
