|
Cheminė formulė
Cheminės reakcijos lygtis
Cheminių reakcijų tipai
Reakcijos produkto A išeiga
Atominis masės vienetas (u)
Elemento santykinė atominė masė
Absoliučioji atominė masė
Junginio santykinė molekulinė masė
Absoliučioji molekulinė masė
Medžiagos kiekis (mol)
Medžiagos molinė masė
Elemento X masės dalis junginyje XxYyZz
Cheminė formulė:
XxYyZz...,
čia
X,Y,Z...
- cheminių elementų simboliai,
x,y,z -
indeksai. Cheminės formulės būna
molekulinės, emperinės ir struktūrinės.
Molekulinė formulė
rodo, kiek vieno elemento atomų
yra molekulėje.
Empirinė formulė
rodo įvairių elementų
atomų kiekių santykius sveikaisiais skaičiais.
Struktūrinė formulė
- atomų jungimosi molekulėje
tvarką ir ryšių skaičių tarp atomų.
Junginių cheminės formulės
|
Pavadinimas |
Molekulinė formulė |
Empirinė formulė |
Struktūrinė formulė |
Sieros (IV) oksidas
|
SO2 |
SO2 |
O
= S =
O |
Vandenilio peroksidas
|
H2O2 |
HO |
H
― O ― O ― H |
Acto rūgštis
|
C2H4O2 |
CH2O |
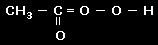 |
Cheminės
reakcijos lygtis :
aA + bB ―> cC + dD,
čia
a, b, c, d -
stechiometriniai
koeficientai, A, B, C,
D - reagentų cheminės
formulės.
Cheminių reakcijų
tipai
1. Skilimo reakcija:
A
―> B + C + ...
2. Jungimosi reakcija:
A + B + ...
―> C
3. Pavadavimo reakcija:
A (vieninė medžiaga)
+ B (sudėtinė
medžiaga)
―> C
(sudėtinė
medžiaga)
+ D
(sudėtinė medžiaga)
Reakcijos produkto A išeiga
ŋ
(A)
=
m eksp(A)/mteor(A)
= neksp(A)/nteor(A)
Atominis masės vienetas (u)
1 u
= m(12C)/12
=
1,66057
· 10-27kg
= 1,66057 · 10-24g
Elemento santykinė atominė masė
Ar = m
(atomo) / 1 u
Absoliučioji atominė masė
m
(atomo)
=
Ar
·
1 u
Junginio santykinė molekulinė
masė
Mr
= m
(molekulės) / 1 u
Absoliučioji molekulinė masė
m
(molekulės)
=
Mr
·
1 u
Medžiagos kiekis (mol)
n = N / NA
čia
N - atomų
(molekulių) skaičius,
NA -
Avogadro konstanta,
NA
= 6,02 ·
1023 mol -1
Medžiagos molinė masė
M = m
/ n
čia
m -
medžiagos masė (g),
n -
medžiagos
kiekis (mol)
Elemento X masės dalis junginyje XxYyZz
ω
(X) =
x
· Ar(X)
/ Mr(XxYyZz)
|

![]()

