
![]()
(c
 |
)
|
Laidumas
elektrai |
||||
| Laidumas elektrai | ||||
|
Elektrolaidumą nustatantį prietaisą įdėjus į stiklinę su dejonizuotu vandeniu, lemputė nežiba. Grynas vanduo – ne elektrolitas. Elektrolaidumą nustatantį prietaisą įdėjus į ledinės acto rūgšties stiklinę lemputė nežiba. Ledinė acto rūgštis – ne elektrolitas. |
||||
 |
 |
|||
|
Įpylus vandens į acto rūgštį lemputė
užsižiebia akinančia šviesa. Vanduo jonizuoja acto rūgštį.
Acto rūgšties tirpalas
–
elektrolitas. CH3CO2H (aq) + NH3(aq) ↔ CH3CO2- (aq) + NH4+(aq) |
||||
 |
 |
|||
|
Grynas vanduo – ne elektrolitas. |
||||
 |
||||
|
Acto rūgšties 0.1M vandeninis tirpalas – silpnas elektrolitas. |
||||
 |
 |
|||
|
Amoniako 0.1M vandeninis tirpalas – silpnas elektrolitas. |
||||
 |
 |
|||
|
Sumaišius acto ir amoniako tirpalus vyksta neutralizacijos reakcija, kurios metu susidaro druska - amonio acetatas. |
||||
 |
 |
 |
||
 |
||||
|
Amonio acetatas – stiprus elektrolitas, lemputė žiba ryškiai. |
||||
 |
||||
|
Druskos rūgštis - stiprus elektrolitas – lemputė žiba akinančia šviesa |
||||
 |
||||
|
Acto rūgštis - silpnas elektrolitas – lemputė žiba silpnai. |
||||
 |
 |
|||
|
Stipraus elektrolito 0.1M druskos rūgšties tirpalo pH = 1.2, o silpno elektrolito 0.1M acto rūgšties tirpalo pH = 2.9. Tirpalai turi vienodą koncentraciją, bet silpnas elektrolitas mažiau jonizuojasi nei stiprus elektrolitas. |
||||
 |
 |
|||
|
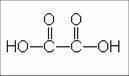
Dikarboninės rūgštys stipresnės už monokarbonines. Vieno karboksilo įtaka kito rūgštingumui tuo didesnė, kuo arčiau jie yra vienas kito. Stipriausia – oksalo rūgštis (stipresnė už acto rūgštį maždaug 2000 kartų). |
||||
| Oksalo rūgštis | Malono rūgštis | |||
 |
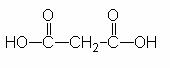 |
|||
 |
 |
|||
|
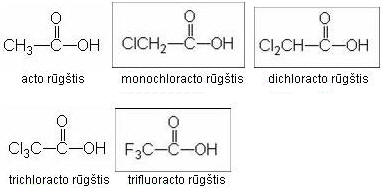
Reagentai: indikatorius – metilas violetinis, acto rūgštis, monochloracto rūgštis, dichloracto rūgštis, trichloracto rūgštis, trifluoracto rūgštis |
||||
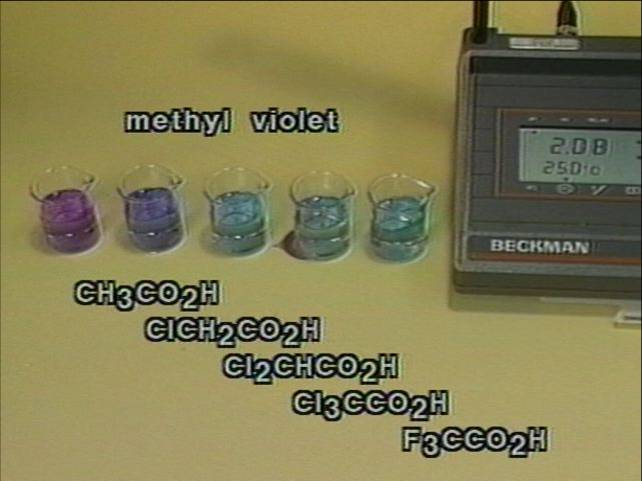 |
 |
|||
|
Halogenas, atitraukdamas elektronus, sustiprina rūgštines karboksilo
savybes. Taip pasireiškia halogeno neigiamas indukcinis efektas (- efektas) |
||||
 |
 |
 |
||
 |
 |
|||
|
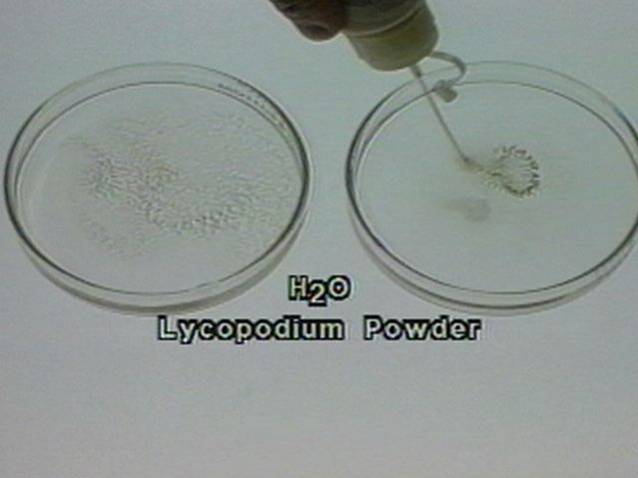
Reagentai: vanduo, pataiso milteliai,
oktanas ir oktano rūgštis. |
||||
 |
||||
|
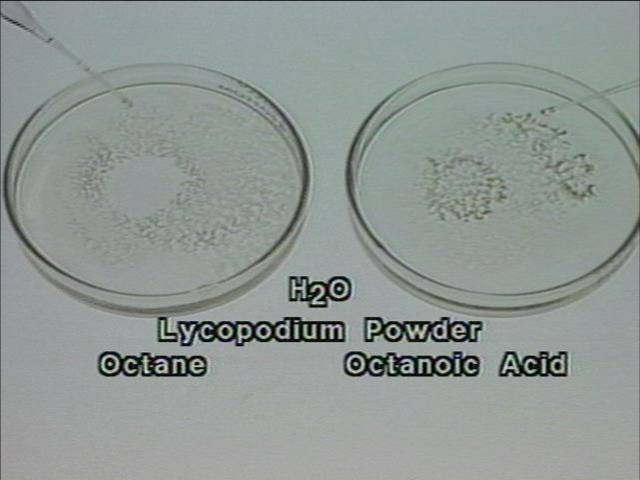
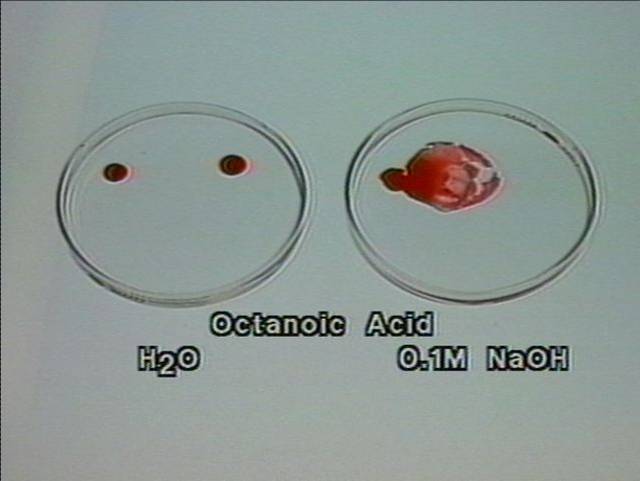
Į pirmą lėkštutę įpilama oktano, į antrą - oktano rūgšties.
Oktanas
– nepolinė medžiaga, todėl lieka lašo pavidalo ir |
||||
 |
 |
|||
|
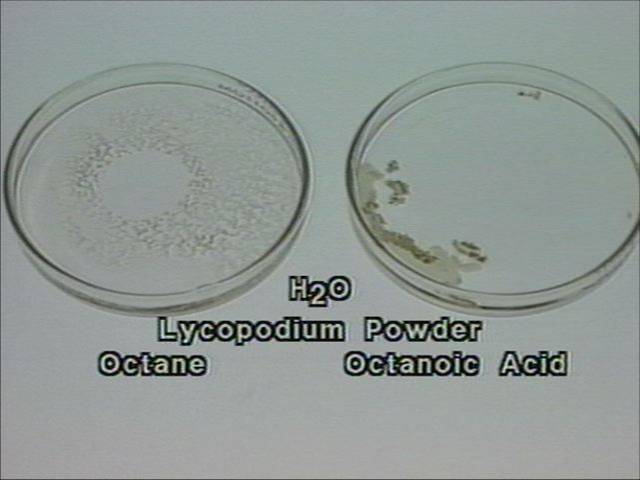
Karboninių rūgščių angliavandenilio likutis hidrofobinis. Aukštesnės rūgštys vandenyje beveik netirpsta. |
||||
 |
 |
|||
|
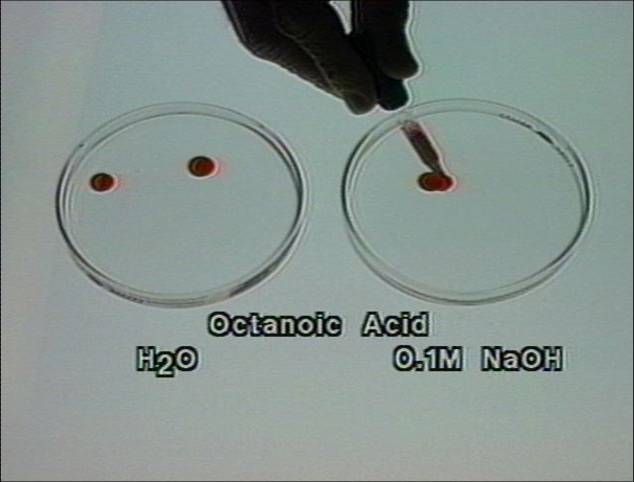
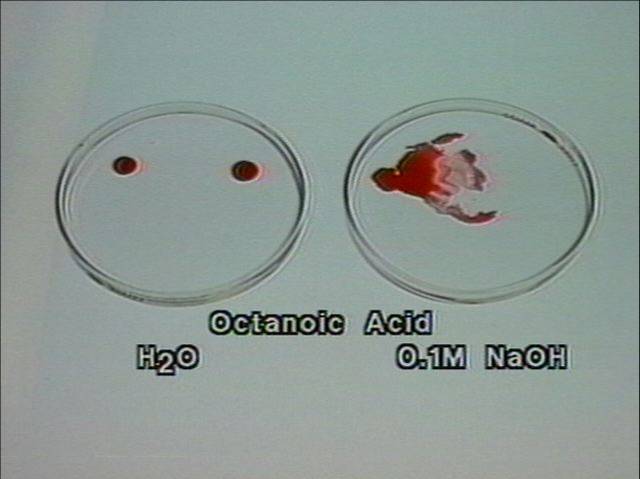
Vienok visos rūgštys tirpsta, sudarydamos druskas vandeniniuose šarmų
tirpaluose. |
||||
 |
 |
|||
|
Muilai – karboninių (riebiųjų) rūgščių druskos |
||||
|
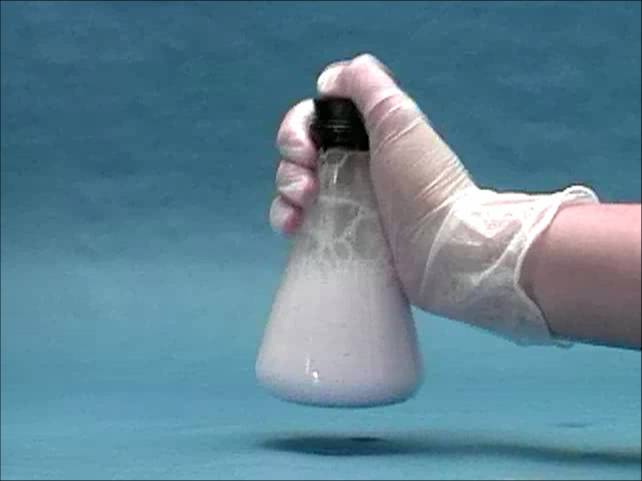
Reagentai: vanduo, žibalas, muilas. |
||||
 |
 |
 |
||
 |
 |
 |
||
|
Kolbos turinys suplakamas. Susidaro daug putų, skysčiai susimaišo. Muilo R – COONa molekulės sudarytos iš hidrofobinės grupės –angliavandenilio radikalo R, kuris mažina giminingumą vandeniui, ir iš polinės hidrofilinės grupės COONa. Hidrofilinė grupė panardinta į vandenį, o hidrofobinė – išstumta iš vandens. Dėl tokios muilo molekulių orientacijos dviejų fazių sąlyčio paviršiuje sumažėja įtempimas, o muilo tirpalo gebėjimas vilgyti ir sudaryti putas padidėja, taigi sustiprėja jo plaunančioji galia. |
||||
 |
 |
|||
Vienintelis visų teisių savininkas (įskaitant visas su juo
susijusias autorines teises) į
Chemistry Comes Alive!
vaizdinę – foto medžiagą yra
Journal of Chemical Education.
Visos teisės saugomos. Naudojama turint leidimą.


