
![]()
(c
 |
)
|
Siera |
||||
|
Sieros dioksido susidarymas |
||||
 |
 |
 |
||
 |
||||
|
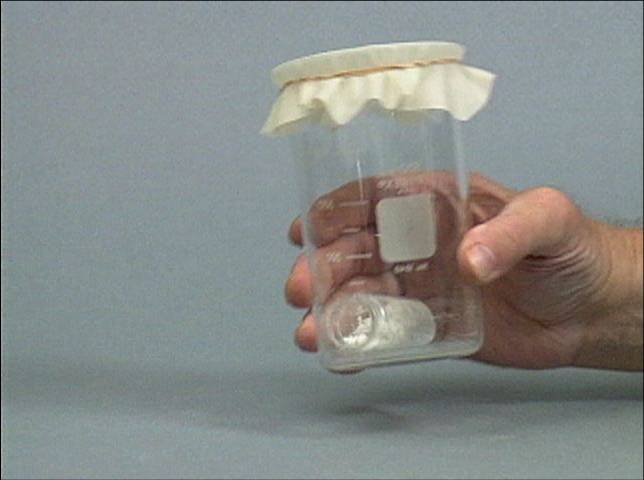
Bandymas Nr.2 Reagentai: natrio sulfitas, druskos rūgštis. Į Biuchnerio kolbą įberiama natrio sulfito. Kolba uždaroma kamšteliu, i kurį yra įstatytas dalijamasis piltuvėlis, pripildytas druskos rūgšties. Kolba su lanksčiuoju vamzdeliu sujungiama su stikline. Į kolba įpilama druskos rūgšties. Vyksta reakcija, jos metu susidaro sieros dioksidas, kuris užpildo visą stiklinę: Na2SO3(k) + 2 HCl (aq) → 2 NaCl (k) + SO2(d) + H2O(s) |
||||
 |
 |
 |
||
|
Sieros dioksido
balinančios savybės Bandymas Nr.1 Reagentai: sieros dioksidas ir rožė. |
||||
 |
 |
 |
||
 |
||||
|
Bandymas Nr.2 Reagentai: K2MnO4 (kalio manganato) ir kalio dichromato (K2CrO4) tirpalai ir sieros dioksidas. Įpylus violetinio kalio manganato K2MnO4 (aq) tirpalo į sieros dioksidą, jo spalva visiškai nublunka - MnO42- jonai redukuojasi iki Mn2+jonų, o S2- jonai oksiduojasi iki SO42-jonų: 5SO2(d) + 2MnO4 2-(aq) + 2H2O(s) → 5SO42-(aq) + 2Mn2+(aq) + 4H+(aq) Įpylus į sieros dioksidą geltono kalio dichromato tirpalo, jo spalva pasikeičia į žalia: CrO42- jonai redukuojasi į žalios spalvos Cr3+ jonus: 3SO2(d) + 2CrO42-(aq ) + 2H 2O(s) → 3SO42-(aq ) + 2Cr3+(aq ) + 4OH-(aq ) |
||||
 |
 |
 |
||
 |
||||
|
Sieros dioksido
sąveika su natrio karbonatu Reagentai: natrio hidroksido ir kalcio oksido mišinys ir sieros dioksidas. Didelėje stiklinėje yra buteliukas su NaOH ir CaO mišiniu. Į stiklinę leidžiamos sieros dioksido dujos. Stiklinė uždengiama ir buteliukas su mišiniu apverčiamas. Buteliuko turinys pradeda reaguoti su stiklinėje esančiu sieros dioksidu: CaO (k) + SO2 (d) → CaSO3 (k) Susidarius CaSO3 kristalams, sieros dioksido dujų tūris sumažėja, o slėgis krenta, dėl to stiklinės uždengimas įtraukimas į vidų. |
||||
 |
|
 |
||
 |
|
|||
|
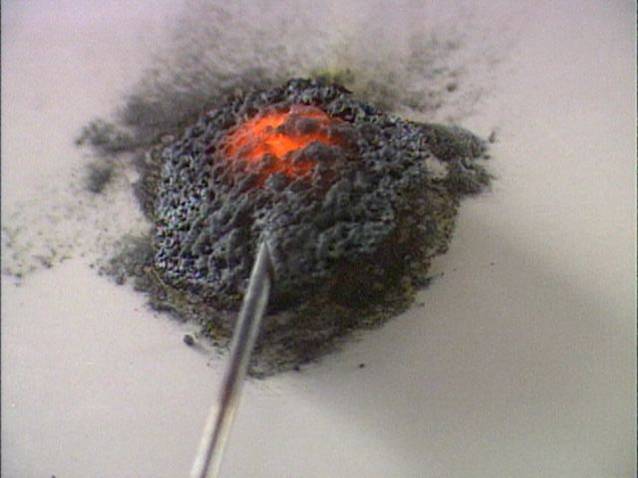
Sąveika su metalais su geležimi Sumaišomi sieros ir geležies milteliai. Įkaitinamas metalinis strypas. Įkaitintas strypas paskatina egzoterminės reakcijos pradžią. Reakcijos metu susidaro geležies sulfidas: 8Fe (k) +S8 (k) → 8FeS (k) |
||||
 |
|
 |
||
 |
||||
|
su cinku Sumaišomi sieros ir cinko milteliai. Įkaitintas strypas paskatina egzoterminės reakcijos pradžią. Reakcijos metu susidaro cinko sulfidas: 8Zn (k) +S8 (k) → 8ZnS (k) |
||||
 |
 |
 |
||
 |
||||
|
Plastiškoji siera Sieros milteliai šildomi tol, kol išsilydo ir pakeičia spalvą į rudą. Iš pradžių suskystinta siera teka laisvai. Esant 113° C, tarp S8 molekulių atstumai yra didesni ir jos juda chaotiškiau nei kietoje būsenoje. Pakilus temperatūrai iki 180° C skystis tampa tirštesnis. Tai įvyksta dėl to, kad S8 žiedai nutrūksta ir susidaro ilgos, susipynę tarpusavy sieros atomų grandinės. Pakilus temperatūrai iki 200° C siera vėl suskystėja ir gali tekėti. Tai įvyksta dėl didelio “S-S” ryšių skaičiaus nutrūkimo – formuojamos trumpesnės grandinės, kurios laisvai juda viena kitos atžvilgiu. Pakilus skysčio temperatūrai iki 445° C, jis užverda. Garai užsidega ir virš stiklinės pasirodo mėlyna ugnis. Skystos sieros įpilama į stiklinę su vandeniu. Susidaro plastiškoji siera, kurią galima ištempti lyg siūlą ir ji nelūžinės. Tai vyksta dėl to, kad staigiai atšaldžius ilgos sieros grandines išsitęsia, bet nelūžta. |
||||
 |
 |
 |
||
 |
 |
 |
||
 |
||||
Vienintelis visų teisių savininkas (įskaitant visas su juo
susijusias autorines teises) į
Chemistry Comes Alive!
vaizdinę – foto medžiagą yra
Journal of Chemical Education.
Visos teisės saugomos. Naudojama turint leidimą.





